Ионообменная хроматография
Ионообменная хроматография получила новый этап в своем развитии в 1975 г., когда Смолл, Стивенс и Баумен предложили ионообменную хроматографию с кондуктометричес-ким детектированием.
Ионообменная хроматография, являющаяся разновидностью жидкостной хроматографии, основана на эквивалентном обмене ионов раствора на ионы твердой фазы. В отличие от абсорбции ионный обмен описывается стехиометрическим химическим уравнением, что важно и для ионной хроматографии. Однако в ионообменниках часто наблюдается и физическая адсорбция.
Разделение в этом случае происходит благодаря разному сродству компонентов определяемой смеси к неподвижной фазе и, следовательно, разным скоростям перемещения по колонке.
Неподвижной фазой в ионообменной хроматографии являются ионообменники: катиониты (слабо- и сильнокислотные) и аниониты (слабо- и сильноосновные).
Основные хроматографические разделения с применением ионообменников проводят в водных растворах, смешанных растворителях (вода — метанол) или в водных буферных растворах.
Ионообменная хроматография широко используется для решения многих биохимических проблем в научных исследованиях.
Для практических целей ионообменную хроматографию наиболее широко используют для анализа аминокислот. Особенно широкую популярность ионообменная хроматография аминокислот получила с появлением аминокислотных анализаторов, позволяющих автоматизировать почти все стадии анализа за исключением подготовки пробы.
Автоматический аминокислотный анализатор позволяет проводить анализ смеси аминокислот белковых гидролизатов. Структурная схема аминокислотного анализатора представлена на рис. 4.9.
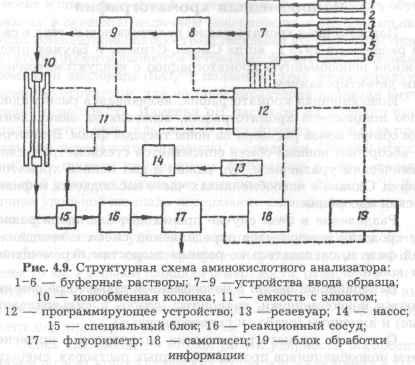
Подача буферных растворов (1-6) на ионообменную колонку (10) осуществляется с помощью соленоидных клапанов и насоса через автоматическое устройство ввода образца (7-9). Колонку заполняют специальной ионообменной смолой, которая должна обладать высокой разрешающей способностью и устойчивостью к давлению.
Нингидрин (или флуорескамин, или офталевый диаль-дегид) подается специальным насосом (14) из резервуара (13) и смешивается с элюатом (11), вытекающим из колонки, в специальном блоке (15). Затем полученная смесь подается в реакционный сосуд (16) для получения производных с после-
дующим детектированием с помощью фотометра или флуо-риметра (17) по поглощению или флуорисценции и регистрацией на самописце (18). Контроль над процессами осуществляется с помощью программирующего устройства (12). В блоке обработки информации (19) происходит анализ полученных результатов, а также сравнение интенсивности сигналов отдельных аминокислот со стандартной смесью и определение абсолютного количества каждой аминокислоты в исследуемом гидролизате. Идентификацию каждой аминокислоты проводят по соответствующему времени удерживания. После анализа автоматически осуществляется регенерация сорбента в колонке.
В настоящее время разработано несколько способов получения окрашенных, или флуоресцирующих производных аминокислот.
Аминокислоты в элюате после ионообменной колонки детектируют по интенсивности окрашенных в фиолетовый цвет производных, которые получаются после взаимодействия аминогрупп с нингидрином. В первую очередь в реакцию с нингидрином вступают первичные аминогруппы с образованием интенсивно окрашенных продуктов реакции, которые детектируют при 570 нм. Вторичный аминпролин образует продукт реакции с меньшей интенсивностью окраски, его детектируют при 440 нм. Одновременную регистрацию при двух длинах волн осуществляют с помощью двухканального самописца. Так как интенсивность окрашивания зависит от строения аминокислоты, необходимо проводить калибровку прибора с использованием стандартной смеси. В зависимости от типа прибора и вида определяемых аминокислот продолжительность анализа составляет от 45 мин. до 2 ч. На рис. 4.10 приведена хроматограмма разделения аминокислот гидроли-зата белка.