Пострегистрационный мониторинг за оборотом пищевой продукции, полученной из гми
На 1 декабря 2004 г. в Российской Федерации прошли полный цикл всех необходимых исследований и разрешены для использования в пищевой промышленности и реализации населению без ограничений 13 видов продовольственного сырья из ГМИ и 5 видов ГММ . В середине 2007 г. этот перечень включал уже 17 линий ГМ-растений: 3 линии сои, 8 линий кукурузы, 4 сорта картофеля, 1 линия риса и 1 линия сахарной свеклы .
Кроме того, существует целый ряд продовольственного сырья, имеющего генетически модифицированные аналоги, разрешенные для реализации на мировом продовольственном рынке, но не прошедшие процедуру регистрации в Российской Федерации, которые потенциально могут попасть на внутренний рынок и подлежат контролю на наличие ГМИ .
Система оценки безопасности пищевой продукции из ГМИ предполагает проведение пострегистрационного мониторинга за оборотом этой продукции. Для осуществления мониторинга разработана необходимая нормативно-методическая база, включающая методы лабораторных исследований, необходимые для организации и проведения эффективного надзора за данной группой продукции.
В соответствии с постановлением Главного государственного санитарного врача РФ № 13 от 31.12.2004 г. «Об усилении надзора за пищевыми продуктами, полученными из ГМИ» во всех федеральных округах РФ при территориальных управлениях Федеральной службы по надзору в сфере защиты прав потребителя и благополучия человека образованы головные центры по количественному определению ГМИ в продуктах питания . Всего в России создано 7 таких центров.
Головные центры проводят исследование пищевых продуктов, в том числе импортных, на наличие в их составе ГМИ. Список продуктов, подлежащих мониторингу, включает следующие виды продукции: ♦ мясо и мясные продукты;
♦ птица и птицеводческие продукты;
♦ молоко, молочные продукты, включая масло и сметану;
♦ рыба, рыбные продукты и др. продукты моря;
♦ хлебобулочные и мукомольно-крупяные изделия;
♦ сахар и кондитерские изделия;
♦ овощи и бахчевые, в том числе картофель;
♦ плоды и ягоды;
♦ дикорастущие пищевые продукты;
♦ жировые растительные продукты;
♦ пиво и безалкогольные напитки;
♦ алкогольные напитки;
♦ мед и продукты пчеловодства;
♦ продукты детского питания;
♦ консервы;
♦ зерно и зернопродукты;
♦ прочие.
Ежеквартально центры представляют в ФГУЗ «Федеральный центр гигиены и эпидемиологии» информацию о результатах исследования пищевых продуктов на наличие ГМИ. В информации указываются общее число исследованных проб продовольственного сырья и пищевых продуктов и число проб, содержащих ГМИ, в том числе без декларации о наличии ГМИ. Для сбора таких данных разработан специальный шаблон «Учет продуктов питания, полученных из ГМИ» .
Так, из исследованных Федеральной службой по надзору в сфере защиты прав потребителей и благополучия населения в 2008 г. 47 935 проб пищевых продуктов, ГМО выявлены в 296 пробах (0,62%), в импортных продуктах — в 32 пробах (0,35%). Наиболее часто ГМО обнаруживались в группах «жировые растительные продукты» (4,61%) и «мясные продукты (1,08 %)». Следует отметить, что количество проб, подвергнутых исследованию на наличие ГМО, с каждым годом возрастает. Например, в 2003 г. было исследовано 4 300 проб, 2004 г. — 12 956, 2005 г. — 18 872, 2006 г. — 37 879, 2007 г. — 44 411. При этом доля проб с ГМО или их компонентами постоянно сокращается: 2003 г — 11,9%, а в 2008 г., как уже указывалось выше. 0,62% .
При надзоре за пищевыми продуктами, полученными из ГМИ, выявлены факты фальсификации данной продукции, когда на пищевой продукт, содержащий генетически модифицированные компоненты, представлялись документы, в которых декларировалось их отсутствие. Среди фальсифицированной продукции оказались концентрат соевого белка «Primeprotein S», производитель «Nutrac B.V.», Нидерланды; концентрат соевого белка «РгоТесСОn G», производитель «SoyProTec LTD.Р.0.136», Израиль; и др.
Введение пострегистрационного мониторинга за пищевой продукцией, имеющей ГМ-аналоги, потребовало разработки надежных методов идентификации ГМ-компонен-тов в пищевых продуктах.
Имеющиеся в арсенале исследователей методы идентификации основаны на выявлении химических соединений, синтезирующихся в клетках ГМ-растений или микроорганизмов в ответ на введение импортируемых (чужеродных) генов. Это в первую очередь трансгенная ДНК и новый экспрессированный белок, а также другие химические соединения: высокомолекулярные жирные кислоты, витамины, сахара. Изменения в химическом составе пищевых продуктов, полученных из ГМ-сырья, позволяют выявить химические методы исследований, такие как хроматография, спектрофотометрия и ряд других. Так, изучение генетически модифицированных линий сои G 94-1, G 94-19, G 168 показало изменение их жирнокис-лотного состава. В частности, было выявлено значительное увеличение содержания олеиновой кислоты — до 83,6% по сравнению с традиционными аналогами — 23,15% . Применение метода газовой хроматографии позволило выявить данную генетическую модификацию даже в рафинированном соевом масле, не содержащем ДНК и белок.
Для определения в продукте нового экспрессирован-ного белка применяют иммунологические методы Вестерн блоттинг и ELISA (непрямой твердофазный иммунофер-ментный анализ). Методы основаны на применении специфичных антител для связывания модифицированного белка. Присутствие белка регистрируется по развитию цветной реакции, интенсивность которой пропорциональна
количеству белка, выделенного из испытуемого продукта. Этими методами можно определить экспрессирован-ный белок как в сырье, так и в продуктах его переработки. Судя по данным, приведенным в табл. 8 , методы Вестерн блоттинг и ELISA проявляют одинаковую чувствительность при обнаружении модифицированного белка в необработанных соевых бобах. Для технологически обработанного сырья (изолят и концентрат соевого белка) предпочтительнее использовать метод ELISA, который оказался более чувствительным.
Предел определения модифицированного белка сои линии 40-3-2, устойчивой к глифосату, для Вестерн блоттинг - и ELISA-анализа соевых бобов и продуктов их переработки, %
|
Продукт (источник белка) |
Предел обнаружения модифицированного белка | |
|
Вестерн блоттинг |
ELISA | |
|
Соевые бобы |
0,25 |
0,25 |
|
Изолят соевого белка |
0,6 |
0,5 |
|
Концентрат соевого белка |
0,8 |
0,25 |
|
Мука соевая крупного помола |
1,0 |
1,4 |
Однако применение этих методов в широкой практике ограничено из-за их трудоемкости и высокой стоимости. Кроме того, разнообразный набор генов, которые применяются при создании трансгенных растений, ограничивает возможности применения иммуноферментных методов для идентификационных анализов, так как они требуют использования специфических антител для каждого вида модифицированного белка, который начинает экспрессироваться в растении в ответ на введение искусственной генетической конструкции. Это не позволяет использовать скрининговые методы для выявления разных генетических модификаций.
Обнаружение модифицированного белка в пищевых продуктах также может быть затруднено в связи с тем, что при технологической обработке сырья зачастую создаются условия (высокая температура, кислая среда, ферментативная обработка), которые вызывают денатурацию белка. По этой причине иммунологический анализ может давать нестабильные или плохо воспроизводимые результаты. И, наконец, уровень экспрессии белка в частях растений, которые служат для приготовления пищевых продуктов, как правило, низкий — не выше 0,06% (как свидетельствуют данные табл. 8, предел чувствительности иммунологических методов — 0,25%) также ограничивает применение Вестерн блоттинг-технологии и ELISA-анализа.
Наиболее надежный метод обнаружения ГМ-компонен-тов в сырье и пищевых продуктах — исследование ДНК с использованием полимеразной цепной реакции (ПЦР) в различных модификациях . По сравнению с модифицированным белком, который экспрессируется не во всех частях растения, ДНК можно выделить из любых клеток и затем использовать для идентификационных целей. Как и в случае с белками, ДНК может разрушаться в процессе технологической обработки под действием высоких температур, обработки кислотами и ферментами. Кроме того, даже если возможно выделение ДНК в необходимых для анализа количествах, проведение ПЦР может быть затруднено из-за присутствия в пробе нитей нуклеиновой кислоты слишком короткого размера, что не позволяет осуществить амплификацию таких молекул. Установлено, что ДНК не определяется в пищевых продуктах, подвергшихся значительной технологической обработке: гидролизованных растительных белках, высокорафинированных маслах и крахмалах, соевом соусе, сахаре и этиловом спирте из генетически модифицированного картофеля .
Схема проведения полимеразной цепной реакции (ПЦР)
Несмотря на определенные ограничения использования методов, основанных на обнаружении трансгенной ДНК, у них имеется крайне важное преимущество. Поскольку, как уже указывалось выше, генетические конструкции для трансформации клеток содержат кроме вводимого гена и определенные регуляторные последовательности (промотор 35S из вируса мозаики цветной капусты, терминатор nos из бактерии Agrobacterium tumifaciens и др.), возможно применение скрининговых анализов, позволяющих обнаружить эти и другие регуляторные последовательности, а следовательно, и трансгенную ДНК.
В настоящее время все шире применяется технология ПЦР в реальном времени. В этом методе, в отличие от традиционной ПЦР, этап детекции совмещен с этапом
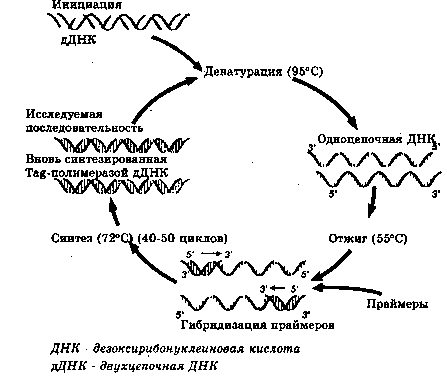
Схема проведения полимеразной цепной реакции (ПЦР)
амплификации: продукты реакции детектируются в реальном времени методом флуоресценции . Флуоресцентный сигнал регистрируется на каждом цикле амплификации, при этом специфический олигонуклеотид-ный зонд, меченный флуорохромом, гибридизуется с ДНК-мишенью. Поскольку количество амплифицирован-ной ДНК возрастает в каждом цикле, интенсивность флуоресценции также увеличивается. На каждом цикле измеряется флуоресцентный сигнал, и компьютерная программа строит график зависимости интенсивности флуоресценции в образце от номера цикла.
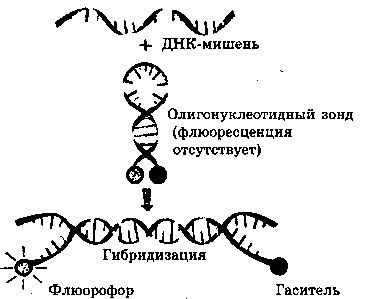
Схема технологии ПЦР в реальном времени
С целью выявления присутствия трансгенной ДНК в пищевом сырье и пищевых продуктах разработаны и стандартизированы два метода идентификации ГМИ растительного происхождения для осуществления пострегистрационного мониторинга за оборотом пищевой продукции, имеющей ГМ-аналоги: ГОСТ Р 52173-2003. «Сырье и продукты пищевые. Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения» , ГОСТ Р 52174-2003. «Биологическая безопасность. Сырье и продукты пищевые. Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения с применением биологического микрочипа» . Эти стандарты введены с 1 июля 2004 г., они распространяются на пищевое сырье и устанавливают методы идентификации ГМИ растительного происхождения. Оба метода основаны на применении ПЦР, праймерами для которой являются определенные регуляторные последовательности, используемые при создании векторных генетических конструкций, обеспечивающих перенос «нужного» гена в клетку хозяина. Метод, предложенный в первом стандарте (ГОСТ Р 52173), предполагает использование праймеров на промотор 35S вируса мозаики цветной капусты и на промотор nos из агробактерии Agrobacterium tumifaciens. Во втором стандарте (ГОСТ Р 52174) кроме двух уже указанных - еще 3: праймеры на маркерный ген gus из бактерии Escherichia coli, на маркерный ген nptll из транспозона Тп5 бактериального происхождения и на терминатор ocs из агробактерии Agrobacterium tumefaciens . Таким образом, возможности определения ГМИ с помощью биологического микрочипа с использованием пяти праймеров на пять различных регуляторных последовательностей значительно шире по сравнению с первым, которым можно выявить лишь два типа регуляторных последовательностей.
Еще одним немаловажным преимуществом второго стандартизированного метода является более удобный и менее трудоемкий способ регистрации результатов анализа. В первом стандарте продукты амплификации ДНК выявляются с помощью горизонтального электрофореза в агарозном геле, а затем анализируются видеосистемой типа «Gel Doe 2000™». Во втором стандарте продукты амПЦР гибридизируются на биологическом микрочипе с последующей идентификацией результатов с использованием аппаратно-программного комплекса «Чипдетектор-03» и соответствующей компьютерной программы «Imageware» для анализа изображений. И, наконец, третье преимуще
ство второго метода — чрезвычайно высокая чувствительность — 10 12 г ДНК.
Таким образом, ввиду явных преимуществ выявления трансгенной ДНК с помощью биологического микрочипа, по-видимому, именно этот метод найдет широкое применение в повседневной практике, даже несмотря на его достаточно высокую стоимость.
Олигонуклеотиды, иммобилизованные на биологическом микрочипе

* Индекс «-и» означает «иммобилизованный».
Суть метода, предлагаемого в стандарте ГОСТ Р 52174, состоит в следующем. Отбирают пробу анализируемого продукта (не более 100 мг). Выделяют из нее ДНК и используют для проведения амПЦР. В качестве положительного контроля применяют раствор заведомо трансгенной ДНК, а в качестве отрицательного — раствор заведомо нетрансгенной ДНК. амПЦР проводят в амплификаторе ДНК по соответствующей схеме. После завершения ПЦР осуществляют гибридизацию продуктов амплификации на биологическом микрочипе.
Биологический микрочип представляет собой стандартное предметное стекло, на поверхности которого в определенном порядке расположены 10 микроскопических ячеек, заполненных полиакриламидным гелем . В пяти из них находятся индивидуальные ковалентно иммобилизованные олигонуклеотиды: 35S, gus, nos, nptll, ocs. Три ячейки с индексом «НК» не содержат иммобилизованных олигонуклеотидов и выполняют роль отрицательного контроля. Две ячейки с индексом «М» содержат ковалентно связанный флуоресцентный краситель и предназначены для однозначной ориентации биологического микрочипа.
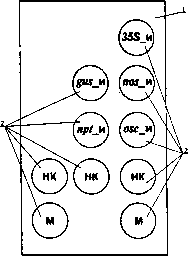
Схема биологического микрочипа для идентификации генетически модифицированных источников растительного происхождения. 1 — предметное стекло, 2 — гелевые ячейки. Пояснения в тексте
Как указывалось выше, визуализацию гибридизационной картины на биологическом микрочипе осуществляют с помощью аппаратно-программного комплекса «Чипдетектор-03» и соответствующей компьютерной программы «Imageware» . Полученную на экране компьютера гибридизационную картину для анализируемой
пробы сравнивают с гибридизационной картиной для положительного контроля (заведомо трансгенной ДНК) и отрицательного контроля (заведомо нетрансгенной ДНК).
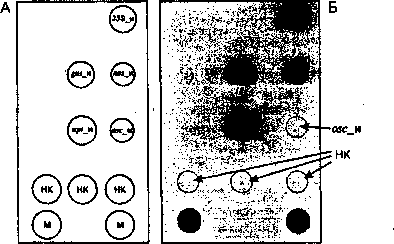
Пример гибридизационной картины на биологическом микрочипе флуоресцентных продуктов амПЦР.
А — схема биологического микрочипа для идентификации генетически
модифицированных источников растительного происхождения, Б — гибридизационная картина на биологическом микрочипе флуоресцентных продуктов амПЦР анализируемой ДНК, содержащей промотор 35S, гены gus и nptll, а также промотор nos. Пунктиром обозначены гелевые ячейки биологического микрочипа с уровнем флуоресценции, близким к фоновой, не достигающим заданного в программе Imageware порога чувствительности
Наличие высокого уровня специфического флуоресцентного сигнала в гелевых ячейках биологического микрочипа, содержащих иммобилизационные олигонуклео-тиды (для промоторов 35S и nos, и терминатора ocs, генов gus или nptll), свидетельствует о присутствии конкретных чужеродных последовательностей ДНК в анализируемой пробе, т.е. о трансгенности анализируемой ДНК и, соответственно, продукта, из которого она выделена. Низкий уровень флуоресцентных сигналов в гелевых ячейках, сравнимый с уровнем фоновой флуоресценции (ячейки с индексом «НК») отрицательного контроля, указывает на отсутствие конкретных чужеродных последовательностей ДНК в анализируемой пробе, т.е. о нетрансгенности анализируемой ДНК и, соответственно, продукта, из которого она выделена. Результаты идентификации заносятся в протокол испытаний, рекомендуемая форма которого приводится в приложении к ГОСТ Р 52174-2003 .
Если в анализируемом образце обнаруживается чужеродная ДНК, то проводится ее количественное определение. Анализ осуществляют согласно МУК 4.2.1913-04 Методические указания «Методы количественного определения генетически модифицированных источников (ГМИ) растительного происхождения в продуктах питания». Определение количественного содержания необходимо для решения вопроса об обязательном или рекомендательном внесении информации о наличии ГМ-компо-нентов на этикетку пищевого продукта.
Таким образом, в настоящее время в России создана определенная законодательная база по оценке качества и безопасности ГМИ пищи. Тем не менее, широкое представительство ГМИ пищи на мировом продовольственном рынке и дальнейшее интенсивное внедрение генно-инже-нерных методов в производство пищевой продукции обусловливают необходимость дальнейшего развития законодательно-нормативной базы в этой области.