Технологии создания гм-растений
Как уже отмечалось, в практике создания новых или улучшенных сортов сельскохозяйственных растений все большее значение приобретает прямое генетическое воздействие на растительный организм. В результате такого вмешательства получается трансгенный организм, геном которого содержит чужеродный генетический материал [5, 34, 47].
Общая схема создания трансгенных растений представлена на
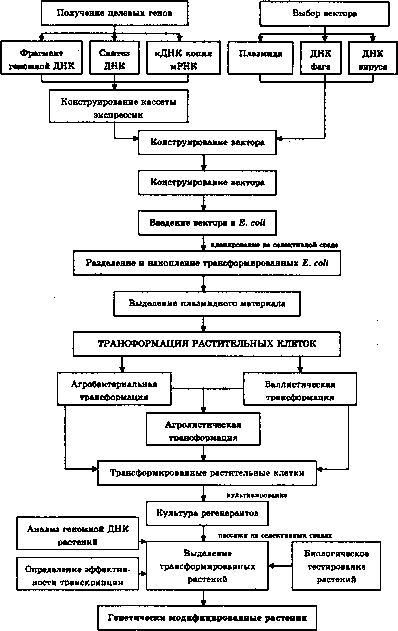
Схема создания генетически модифицированных растений
Основные этапы этого процесса включают:
1) получение целевых генов, предназначенных для введения в растение, и конструирование кассеты экспрессии;
2) конструирование вектора, несущего целевой ген;
3) трансформацию растительных клеток;
4) регенерацию целого растения из трансформированной клетки;
5) детектирование трансформированных растений среди регенерантов.
Получение целевых генов. На первом этапе необходимо получить ген, который будет вводиться в реципи-ентную клетку растения-хозяина. Для этого существует несколько возможностей.
Если расшифрована нуклеотидная последовательность ДНК и картированы гены донорного организма (т.е. известно, какие фрагменты этой ДНК кодируют те или иные признаки), то нужный ген может быть вырезан специальными ферментами рестриктазами из геномной ДНК донора. Другим способом получения целевого гена является химический или ферментативный синтез нужного фрагмента ДНК. И, наконец, искомую нуклеотидную последовательность можно получить ферментативным синтезом ДНК с матричной РНК — кДНК. Таким образом, в результате реализации того или иного способа получают фрагмент ДНК, несущий ген, кодирующий необходимый признак.
Для того чтобы ген после введения его в организм нового хозяина экспрессировался, т.е. работал, и, как результат этого, в клетке синтезировался соответствующий белок, необходимо снабдить его регуляторными элементами. Регуляторные элементы представляют собой определенные последовательности нуклеотидов, которые позволяют гену функционировать. Обязательными компонентами регуляторных элементов являются:
♦ промотор — участок молекулы ДНК, с которым связывается РНК-полимераза (фермент, катализирующий синтез мРНК), что сопровождается инициацией транскрипции гена;
♦ терминатор — участок молекулы ДНК, определяющий окончание синтеза молекулы мРНК.
В качестве промотора чаще всего используют сильный промотор 35S вируса мозаики цветной капусты. Он относится к конститутивным промоторам, т.е. таким, которые работают на протяжении всей жизни растения. Иногда требуются специфические промоторы — такие, которые активны в отдельных клетках, тканях, органах или лишь на определенных стадиях жизни растений. Например, есть промоторы, которые работают только в клубнях картофеля и никогда не будут работать в его листьях. Наконец, существуют индуцибельные промоторы, которые активируются только под воздействием определенных факторов — химических веществ, температуры и др. В зависимости от того, какой ген должен быть перенесен в растение и в какой период он должен экспрессироваться, для создания вектора выбирают тот или иной промотор.
Таким образом, кассета экспрессии представляет собой группу функционально связанных участков ДНК, в состав которой входят промотор, целевой ген и терминатор.
Конструирование вектора. Сама по себе кассета экспрессии не может попасть в клетку-реципиент и интегрироваться (внедриться) в хромосомы растения-хозяина. Для этого нужен вектор — специальная молекула ДНК, которая может проникать в клетки растений и там самореплицироваться, либо встраиваться в ДНК хозяина и реплицироваться вместе с ней.
В качестве вектора обычно используют ДНК вируса или бактериофага, а также плазмиды бактерий (кольцевые молекулы ДНК, несущие небольшое количество генов и присутствующие в бактериальной клетке наряду с хромосомной ДНК). Именно плазмиды чаще всего применяются для трансформации растений.
Первые попытки создания таких векторных систем основывались на использовании 77-плазмиды (от англ. tumor-inducing plasmid) почвенной бактерии Agrobacterium tumefaciens. A. tumefaciens — фитопатоген, который инфицирует клетки растений, что приводит к образованию опухоли — корончатого галла, нарушающей нормальный
рост растения . Причем, эта бактерия может поражать только клетки двудольных растений.
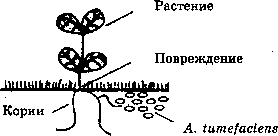
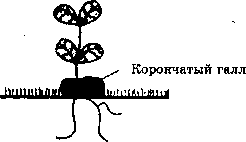
Инфицирование растений A. tumefaciens и образование корончатого галла
Образование корончатого галла является результатом трех взаимосвязанных процессов:
1. Проникновение бактерии в клетку растения.
2. Интеграция в геном растительной клетки специфического сегмента плазмидной ДНК бактерии — Т-ДНК (от англ. transferred DNA — часть плазми-ды, индуцирующей развитие опухоли).
3. Экспрессия отдельных генов Т-ДНК. Инфекционный процесс начинается с прикрепления
A. tumefaciens к клеткам растения в месте повреждения, чаще всего у основания стебля. Поврежденное растение выделяет специфические фенольные соединения, которые активируют гены вирулентности (vir-гены), локализованные в участке Ti-плазмиды за пределами Т-ДНК .
Продукты vir-генов необходимы для транспорта и интеграции Т-ДНК в геном растительной клетки. После активации fir-генов Т-ДНК транспортируется в клетку. При этом она находится в одноцепочечной форме, и именно в такой форме происходит ее встраивание в хромосомную ДНК растения.
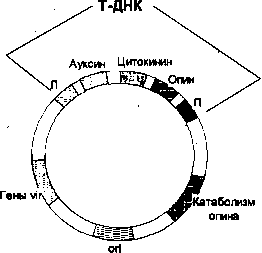
Генетическая карта 77-плазмиды (масштаб не соблюден). Т-ДНК содержит гены ауксина, цитокинина и опина, которые транскрибируются и транслируются только в растительных клетках За пределами Т-ДНК находится кластер vir генов гены кодирующие ферменты катаболизма опина, и сайт инициации репликации (ori), который обеспечивает стабильное поддержание плазмиды в A. tumefaciens Л и П - левая и правая фланкирующие последовательности соответственно
Большинство генов Т-ДНК активируются только после ее интеграции в хромосомную ДНК растения. Их продукты и вызывают образование корончатого галла. Это происходит в результате экспрессии плазмидных генов, кодирующих ферменты, обеспечивающие синтез растительных гормонов ауксина (ИУК — индолилуксусная кислота) и цитокининов. Ауксин и цитокинины регулируют рост и
развитие растительной клетки, но, присутствуя в избытке, могут вызывать у растений образование опухолей.
При использовании 77-плазмиды в качестве вектора для генетической трансформации растений кассету экспрессии, содержащую целевой ген, встраивают в Т-ДНК, а затем такой модифицированной плазмидой, помещенной в бактерию A. tumefaciens, инфицируют клетки растений.
Несмотря на то что 77-плазмиды являются эффективными природными векторами, их использование имеет некоторые ограничения. Наиболее существенные из них следующие:
1. Ауксин и цитокинины, синтезируемые трансформированными 77-плазмидами клетками, подавляют регенерацию зрелых растений из этих клеток. Следовательно, при конструировании векторов на основе 77-плазмид гены ауксина и цитокинина должны быть удалены.
2. Ti-плазмиды имеют очень большой размер (200— 800 тыс. нуклеотидных пар), а для экспериментов с рекомбинантными ДНК нужны векторы меньшего размера. Следовательно, участки ДНК, несущественные для клонирующего вектора, должны быть удалены.
3. 77-плазмиды не реплицируются в кишечной бактерии Escherichia coli (именно в этих бактериях производят клонирование созданного вектора для получения множества его копий, которые в дальнейшем и будут использовать для трансформации растительных клеток). Следовательно, при конструировании векторов необходимо ввести в них сайт инициации репликации, обеспечивающий их воспроизводство в Е. coli.
Кроме манипуляций,, связанных с удалением из 77-плазмид определенных участков ДНК и введения в них сайта инициации репликации кишечной бактерии, в вектор включают специальный ген, который позволяет идентифицировать трансформированные клетки. Он дает возможность обнаружить клетки растений, несущие чужеродную ДНК в составе геномной ДНК трансформиро
ванного растения. Эти гены позволяют либо проводить отбор трансформированных клеток — в этом случае они называются селективными маркерными генами, либо оценивать активность кодируемого ими фермента — регуля-торные гены. Испытано несколько десятков генов, которые можно использовать как селективные маркерные гены, и репортерных генов, чей белковый продукт можно обнаружить с помощью специальных методов .
Как правило, в качестве репортерных используют бактериальный плазмидный ген фермента, который обеспе-
Системы репортерных и селективных маркерных генов растительных клеток
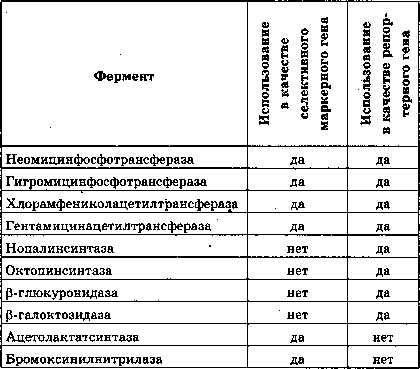
чивает устойчивость трансформированных растительных клеток к тому или иному антибиотику. Чаще всего это ген неомицинфосфотрансферазы, обеспечивающий устойчивость к канамицину. В качестве селективных маркерных генов используют гены, которые кодируют ферменты, обеспечивающие устойчивость растительных клеток к антибиотикам или гербицидам. Так, в присутствии ка-намицина выживают только те клетки, которые синтезируют активную неомицинфосфотрансферазу. Поскольку этот ген бактериальный (прокариотический) и не может экспрессироваться в растениях, его ставят под контроль растительных (эукариотических) сигналов регуляции транскрипции, в том числе промотора и терминатора. Это обеспечивает эффективную экспрессию гена в трансформированных растительных клетках. Однако следует отметить, что, по мнению экспертов-биотехнологов, присутствие некоторых генов и их продуктов может приводить к загрязнению коммерческого продукта. В связи с этим лучше не вводить гены устойчивости к антибиотикам в сельскохозяйственные растения.
Таким образом, осуществив всё необходимые модификации Ti-плазмид, получают вектор, пригодный для трансформации клеток растений.
Все векторы на основе Ti-плазмид организованы сходным образом и кроме кассеты экспрессии содержат следующие элементы:
♦ селективный маркерный ген, который обеспечивает устойчивость трансформированных клеток к антибиотикам;
♦ сайт инициации репликации, который позволяет плазмиде реплицироваться в Е. coli. Некоторые векторы содержат также и сайт инициации репликации A. tumefaciens; .
♦ правая фланкирующая последовательность Т-ДНК, которая абсолютно необходима для интеграции Т-ДНК в клеточную ДНК растений;
♦ полилинкер (множественный сайт клонирования) для встраивания гена в участок между границами Т-ДНК.
Так как клонирующие векторы не содержат uir-генов, то они сами не могут проникать в клетки растения и интегрироваться в их геном. Существуют два способа решения этой проблемы.
В первом случае используют бинарную векторную систему. Бинарный клонирующий вектор содержит сайты инициации репликации (ori) и для Е. сой и для A. tumefaciens, но не несет u/r-генов. Все стадии клонирования проводят в E.coli, а затем вектор вводят в A. tumefaciens, которая несет модифицированную неонко-генную 77-плазмиду. 77-плазмида содержит vir-гены, но из нее удалена Т-ДНК. Таким образом, бактерия не может транспортироваться в клетку растения, но может обеспечить синтез продуктов vir-генов, которые способствуют встраиванию Т-ДНК из бинарного клонирующего вектора в хромосомную ДНК растения. То есть, она выполняет роль помощника интеграции Т-ДНК в геном растительной клетки.
Во втором случае используют коинтегративную векторную систему. Коинтегративный клонирующий вектор, несущий нужный ген, содержит сайт инициации репликации (ori) только для Е. coli и не может автономно существовать в A. tumefaciens. Он также несет бактериальный селективный маркерный ген, правую фланкирующую последовательность Т-ДНК (П), без которой невозможна интеграция в чужой геном, и фрагмент 77-плазмиды, гомологичный участку Т-ДНК неонкоген-ной 77-плазмиды. Неонкогенная 77-плазмида содержит левую фланкирующую последовательность (JI), vir-гены и сайт инициации репликации A. tumefaciens (ori). После рекомбинации коинтегративного клонирующего вектора и неонкогенной 77-плазмиды образуется рекомбинантная плазмида, Т-ДНК которой, несущая клонированный ген, может трансформировать клетки растений.
После накопления клонирующих векторов в Е. coli в нужном количестве и их выделения из этих бактерий возможно использование рекомбинантных ДНК для трансформации растительных клеток.
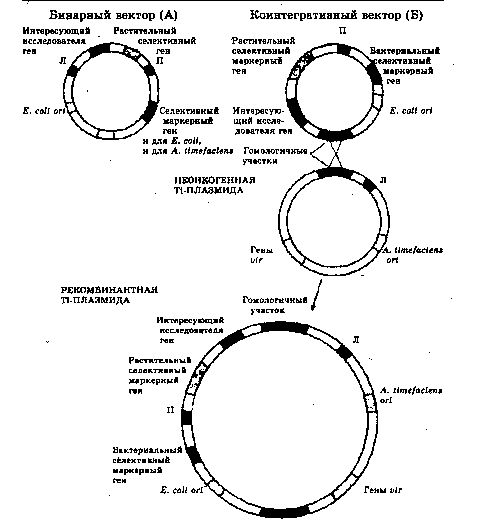
Две векторные системы на основе Ti-плазмид.
А - бинарный, Б - коинтегративный векторы Пояснения в тексте
Две векторные системы на основе Ti-плазмид.
А - бинарный, Б - коинтегративный векторы Пояснения в тексте
Трансформация растительных клеток. Для трансформации растительных клеток был разработан ряд методов: использование Ti-плазмид, бомбардировка микрочастицами, использование векторов на основе вирусов, микроинъекции, электропорация и др. .
Методы введения ДНК в клетки растений
|
Метод |
Эффективность применения и перспективы использования |
|
Использование Ti-плазмид |
Высокоэффективная система. Применима не для всех видов растений |
|
Бомбардировка микрочастицами |
Высокоэффективная система. Может использоваться для широкого круга растений и тканей |
|
Использование векторов на основе вирусов |
Неэффективный способ доставки ДНК в растительные клетки |
|
Микроинъекции |
Применение ограничивается тем, что инъекция одновременно может быть сделана только в одну клетку |
|
Электропорация |
Применение возможно для введения генов только в протопласты, причем растений тех видов, из протопластов которых могут быть регенерированы жизнеспособные растения |
|
Слияние липосом |
— « — |
|
Прямое введение генов в протопласты |
— « — |
Как указывалось выше, такими способами были трансформированы более 50 различных видов растений. Однако в настоящее время для производства трансгенных культур в промышленных масштабах в основном применяют агробактериальный (с помощью Тi-плазмид) и баллистический (бомбардировка микрочастицами) способы модификации растительного генома.
Использование агробактерий, содержащих клонирующий вектор, — достаточно высокоэффективная система, несмотря на то, что частота трансформации составляет 1 из 10000 растительных клеток. Кроме того, как уже отмечалось, они могут быть применены только для переноса генов в двудольные растения, Однодольные растения, включая основные зерновые культуры (рис, пшеница, кукуруза), практически не трансформируются A. tumefaciens. Поэтому для трансформации клеток однодольных чаще всего применяют баллистический способ. Для бомбардировки используют золотые или вольфрамовые сферические частицы диаметром 0,5—2 мкм, покрытые ре-комбинантной ДНК. Этим частицам посредством электрического разряда или сжатым газом придается скорость 300—600 м/с, в результате чего они пробивают клеточную стенку и клеточную мембрану. Попав в клетку, рекомби-нантная ДНК интегрируется в растительную ДНК. Эффективность метода очень высокая — до 15%. Метод бомбардировки микрочастицами позволяет трансформировать растения самых разных видов, в том числе однодольные и хвойные. Ниже указаны трансгенные растения, полученные баллистическим способом:
|
Растение |
Источник клеток для бомбардировки микрочастицами |
|
Кукуруза |
Суспензия зародышевых клеток, незрелые зародыши |
|
Рис |
Незрелые зародыши, зародышевый каллус |
|
Ячмень |
Суспензия клеток, незрелые зародыши |
|
Пшеница |
Незрелые зародыши |
|
Рожь |
Меристема |
|
Банан |
Суспензия зародышевых клеток |
|
Горох |
Зиготические зародыши |
|
Огурец |
Зародышевый каллус |
|
Бобы |
Зиготические зародыши |
|
Виноград |
Суспензия зародышевых клеток |
Выделение трансформированных растений. Трансформированные тем или иным способом растительные клетки культивируют в условиях in vitro на специальных средах, способствующих регенерации из них растеньиц. Таким образом, из одной трансформированной клетки можно вырастить полноценное фертильное растение, все клетки которого несут чужеродную ДНК.
Культивирование регенерантов включает несколько серий пассажей («пересадок») на селективных средах, содержащих антибиотик или гербицид, благодаря чему клетки, в которых нет маркерного гена устойчивости к этим веществам, а следовательно, нет и чужеродной ДНК, погибают.
В дальнейшем с помощью определенных манипуляций добиваются элиминации (удаления) маркерных генов из геномов растеньиц-регенерантов, поскольку присутствие этих генов в культурах, использующихся в качестве сырья для производства продуктов питания, нежелательно.
Отобранные регенеранты используют для анализа геномной ДНК, который позволяет определить присутствие целевого гена и число его копий, интегрированных в геном.
Заключительный этап лабораторного тестирования ТГ-растений включает биологические исследования, определяющие стабильность проявления целевого признака.
Таким образом, с использованием описанных выше технологий к настоящему времени созданы и испытаны в полевых условиях ГМ-формы многих сельскохозяйственных растений. Так, получено значительное количество ТГ-форм томатов (более 260), сои (более 200), хлопчатника (более 150), тыквенных (более 80), а также пшеницы, риса, подсолнечника, яблонь и др. Однако зарегистрировано и допущено к промышленному производству лишь незначительное количество ТГ-форм растений (например, в США — немногим более 100 линий ГМ-растений, в других странах — еще меньше). В России на сегодняшний день в государственном реестре зарегистрированы 17 видов продовольственного сырья из ГМИ и 5 видов ГММ. Это связано с тем, что прежде чем попасть на рынок, продукция, содержащая ГМ-компоненты, должна пройти экспертизу качества и безопасности.